来源:丁香学术 2021-12-03 12:31
睡眠是生命中不可缺少的一部分,它对维持机体的稳态,预防各种疾病等具有重要作用。近年来,随着社会节奏的加快,人们的睡眠时间普遍缩短,平均睡眠质量存在下降,不得不面临着睡眠不足对健康的不利影响,尤其是青年人群。
据报道,在人类中,睡眠不好与自身免疫性疾病、肿瘤和感染的风险增加有关。短期睡眠不足会损害先天免疫系统和适应性免疫系统,导致感染易感性增加;而长期习惯性睡眠不足或通宵工作则可导致全身性慢性炎症,并与各种炎症相关疾病如糖尿病、动脉粥样硬化、神经退行性疾病等相关。总的来说,睡眠不佳会广泛影响免疫系统,并与更高的疾病易感性有关。
中山大学中山眼科中心 & 眼科国家重点实验室苏文如、郑颖丰团队在 Communications Biology 杂志在线发表了题为 Effects of poor sleep on the immune cell landscape as assessed by single-cell analysis 的文章,他们利用质谱流式细胞术(Cytometry by time of flight,CyTOF)和单细胞 RNA 测序技术(scRNA-seq)分析了熬夜整晚后外周血单个核细胞(PBMCs)的特性和变化。
研究发现熬夜可通过重新编程免疫亚群组成、基因表达特征、富集通路、转录调控网络和细胞间相互作用等,来促进外周血的炎性状态。这些发现提供了睡眠不良对免疫系统影响的全面图谱,并扩展了人们对熬夜作为炎症或自身免疫性疾病和衰老相关疾病的诱发因素的认识。
主要研究内容
为了绘制熬夜前后人类外周循环免疫系统的变化,并鉴定出与熬夜相关的细胞特异性改变,研究人员采集了 6 名健康个体熬夜前后的血液样本,然后进行 CyTOF 和 scRNA-seq 分析。利用 scRNAseq,他们共鉴定了巨核细胞、CD34 阳性细胞和 5 个主要免疫细胞谱系。同时,基于每个细胞群体中上调的典型谱系标记基因的表达,他们进一步将 5 个免疫细胞群体细分为 25 个转录亚群。
熬夜影响外周循环细胞免疫系统
为了阐明熬夜后细胞类型组成的变化,他们比较了熬夜前和熬夜后各主要细胞类型的数量和比例。总的来说,熬夜后 T 细胞比例增加了约 3%,髓系细胞比例减少了约 4%。在更加细致的分群中,他们发现 CD8 效应记忆 T 细胞、增殖性 T 细胞和衰竭 T 细胞的比例增加;此外,浆细胞(PCs) 也显着上调。
NK 细胞群数量和比例的分析表明,其亚群组成发生了改变,NK2 比例显着增加,NK3 则显着减少。在髓系细胞中,常规单核细胞和浆细胞均增加。总之,这些分析结果揭示了外周循环中复杂的细胞动力学,进一步支持了熬夜会破坏血液免疫稳态的概念。
熬夜后基因表达的变化
为了识别与熬夜相关的分子事件,他们分析鉴定了熬夜前后血液免疫细胞的差异表达基因(DEGs),发现所有 6 名参与者都显示了一些炎症基因的增加,包括 AP-1 家族基因(JUN, FOS), DNA 损伤标记物(DDIT3, GADD45B),干扰素相关发育调节因子 1(IFRD1)等。
接下来的基因富集和通路分析结果也显示,熬夜后普遍上调的基因在 AP-1 通路、白细胞活化、细胞衰老通路的激活和细胞应激反应中富集;此外,熬夜还导致了与金属离子稳态和解毒相关的多条通路的下调。
熬夜导致淋巴细胞的改变
淋巴细胞在炎症和自身免疫中起着重要作用,使用 CyTOF,他们发现熬夜后淋巴细胞,尤其是 T 细胞的显着增加。此外,所有 B 细胞亚群的分析结果也表明其与炎症状态相关的基因表达在增加,包括 NFKBIA、JUN 和 COX5A。
为了理解熬夜相关的生物学意义,他们使用上调的差异基因进行了通路富集分析,发现熬夜后普遍上调的生物学过程为蛋白质加工和细胞凋亡。值得注意的是,熬夜上调了 CD4、TEM 和 Treg 细胞群体中 IFN-γ 的产生,以及上调了 p38MAPK 和 IL-17 信号通路,这些生物学过程和通路与自身免疫激活密切相关。
总的来说,这些发现表明,熬夜重新编程了循环淋巴细胞的蛋白质组学和转录谱,并可能诱导自身免疫相关的表型。
熬夜后髓系细胞的变化反映了血液中的炎症激活
人外周血髓系细胞,包括单核巨噬细胞和树突状细胞(DC),他们在抗原呈递和炎症过程中发挥着重要功能。分析结果显示,熬夜除了诱发炎症外,还能够诱导髓系细胞衰老的迹象,表明熬夜与衰老之间存在密切关系。
为了探究内在的调控机制,他们评估了其中上调差异基因的核心转录因子。结果发现,熬夜后,转录因子活性在经典 2 型树突状细胞(cDC2)和经典单核细胞子集中上调最多,熬夜能够上调与炎症激活相关的转录因子,包括 NFKB1、RELA、JUN 和 ATF2。
此外,NF-κB 家族参与了多种炎症基因的调控,包括趋化因子(CCL3、CCL4、CXCL2、CXCL8)和炎症细胞因子(IL1B 和 TNF)等。值得注意的是,IL1B 和 TNF 表达在熬夜后的 cDC2 中尤其高。总之,这些结果证明了 cDC2 在熬夜诱导的炎症激活中的关键作用。
熬夜后异常的细胞间通讯模式与免疫功能障碍
复杂的细胞反应始于配体与其同源受体的结合以及特定细胞信号通路的激活。尽管在与不良睡眠相关的研究中强调了免疫功能障碍,但尚未有研究对循环免疫系统中特定的熬夜诱导的细胞间相互作用进行报道。
为了识别熬夜后的细胞间相互作用,研究人员对熬夜前后的细胞间通讯进行了分析比较。结果发现,与熬夜前相比,熬夜后细胞间相互作用的频数出现了增加。进一步的分析显示这些相互作用主要涉及淋巴细胞对其他细胞的炎症激活以及髓系细胞对其他细胞的趋化性。
具体而言,熬夜后显示出独特的细胞间通讯,包括 T 细胞和 DC 之间的 IL18-IL18R1;NKs 和 T 细胞之间的 IL23A-IL23R;B 细胞和 T 细胞之间的 IL12B-IL23R 等。总之,这些发现揭示了熬夜诱导的特定相互作用,并突出了与自身免疫和炎症性疾病有关的信号通路。
结语
综上所述,该团队首次利用 CyTOF 和 scRNA-seq 对熬夜前后的外周血单个核细胞(PBMCs)进行了单细胞维度的转录和蛋白层面的双重分析,获得了睡眠不良或熬夜后的人体循环免疫细胞图谱,并从细胞类型组成、亚群特异性基因表达、富集通路、转录调控网络和细胞间通讯等方面,系统全面地评估了睡眠不足对免疫系统的影响,阐明了熬夜会促进机体的炎症、细胞衰老和免疫功能障碍的影响。
总之,在本研究中,首次应用单细胞技术,提供了睡眠不良对免疫系统影响的全面概况,并扩展了人们对相关生理病理层面的知识。(生物谷Bioon.com)
身体发出的睡眠信号,竟是大脑 DNA 损伤拉响的「警报」
戴老师的体育课堂
2021-11-26 11:21
研究背景
睡眠对所有动物来说都是必不可少的,但每天的睡眠量因物种不同而存在差异。成年人每天大约睡 7-8 个小时,树獭睡 20 个小时,而自由漫游的野生大象只睡 2 个小时。
对于人类来说,我们一生中有三分之一的时间需要花在睡觉上。当我们疲惫不堪的时候,只要好好睡一觉,我们就能元气满满地开始新的一天啦。那么,我们究竟是如何知道自己需要睡觉的,晚上睡眠帮助机体修复的机制是什么?这些仍然是未解之谜。
2021 年 11 月 18 日,来自以色列巴伊兰大学生命科学学院和多学科脑研究中心的 Lior Appelbaum 团队在 Molecular Cell 杂志上发表一项题为 Parp1 promotes sleep, which enhances DNA repair in neurons 的新研究,朝着解开这一谜团迈进了一步。研究人员通过发现斑马鱼的睡眠机制,并在小鼠上得到了证据支持, 发现 DNA 损伤是睡眠的稳态驱动因素,而 Parp1 通路可以感知这种细胞压力并促进睡眠和修复活动。

图片来源: Molecular Cell
研究内容
睡眠可以修复神经元 DNA 损伤
当我们清醒时,神经元中会逐渐积累 DNA 损伤。这种损害可能由多种因素引起,包括紫外线、神经元活动、辐射、氧化应激和酶促反应错误。在睡眠和清醒时间,每个细胞内的修复系统都会纠正 DNA 断裂。然而,神经元中的 DNA 损伤在清醒期间仍然持续累积,大脑中过度的 DNA 损伤会达到危险水平,因此必须降低 DNA 损伤。本研究表明睡眠可以募集 DNA 修复系统,促进有效修复,以帮助我们「重启」新的一天。
在一系列实验中,研究者试图确定 DNA 损伤的累积是否可能是触发睡眠状态的驱动因素。使用辐射、药理学和光遗传学多种实验方法,在斑马鱼上诱导 DNA 损伤,以评估其如何影响斑马鱼的睡眠。斑马鱼十分透明,具有与人类相似的大脑和夜间睡眠,是研究这种现象的完美模式生物。
实验表明,随着 DNA 损伤的增加,对睡眠的需求也增加了。在某个时刻,DNA 损伤的积累达到了最大阈值,并且睡眠(稳态)压力增加到一定程度,以至于触发了睡眠冲动,鱼进入了睡眠状态。随后的睡眠促进了 DNA 修复过程,从而减少了 DNA 损伤。
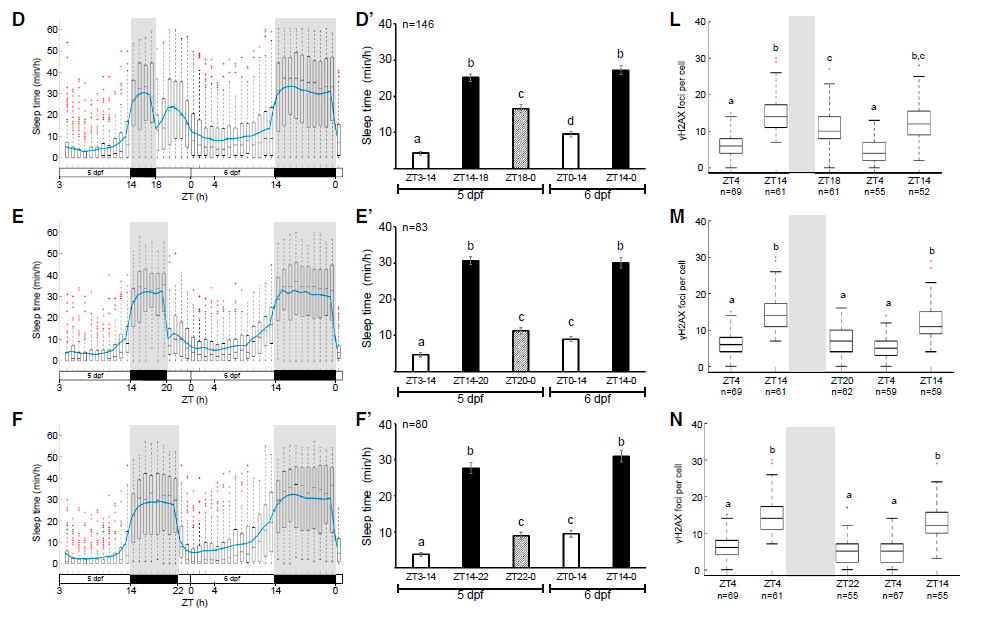
图片来源: Molecular Cell
多少小时的睡眠才足够?
没有什么比睡个好觉更重要的了。在证实累积的 DNA 损伤是驱动睡眠过程的因素后,研究人员进一步确定了减少斑马鱼睡眠压力和 DNA 损伤的最短时间。与人类一样,斑马鱼对光线中断很敏感,因此研究人员逐渐减少夜间的黑暗时间。在检测 DNA 损伤和睡眠后,确定每晚 6 个小时的睡眠足以减少 DNA 损伤。令人震惊的是,在夜间睡眠不足 6 个小时的时候,DNA 损伤并未充分减少,斑马鱼在白天也会继续睡眠。
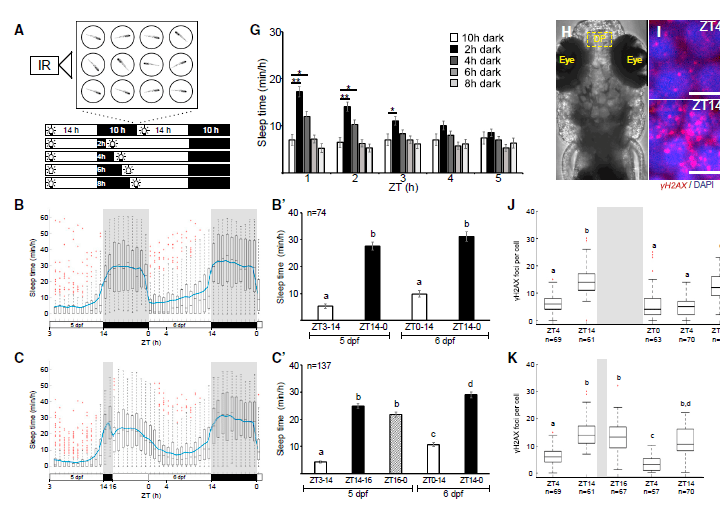
图片来源: Molecular Cell
PARP1 可以发出「该睡觉啦」的信号
为了促进有效 DNA 修复,大脑需要告诉我们该睡觉了,那么其潜在机制是怎样的?
PARP1 蛋白是 DNA 损伤修复系统的一部分,是最早做出快速反应的蛋白之一。PARP1 标记细胞中的 DNA 损伤位点,并招募所有相关系统清除 DNA 损伤。根据 DNA 损伤,清醒时 PARP1 在 DNA 断裂位点的聚集增加,在睡眠时减少。通过遗传和药理学操作,PARP1 的过表达和敲低表明, 增加 PARP1 不仅可以促进睡眠,还可以增加睡眠依赖性修复。相反,PARP1 的抑制阻断了 DNA 损伤修复的信号。有趣的是, 鱼没有完全意识到自己累了,并没有睡觉,也没有进行 DNA 损伤修复。
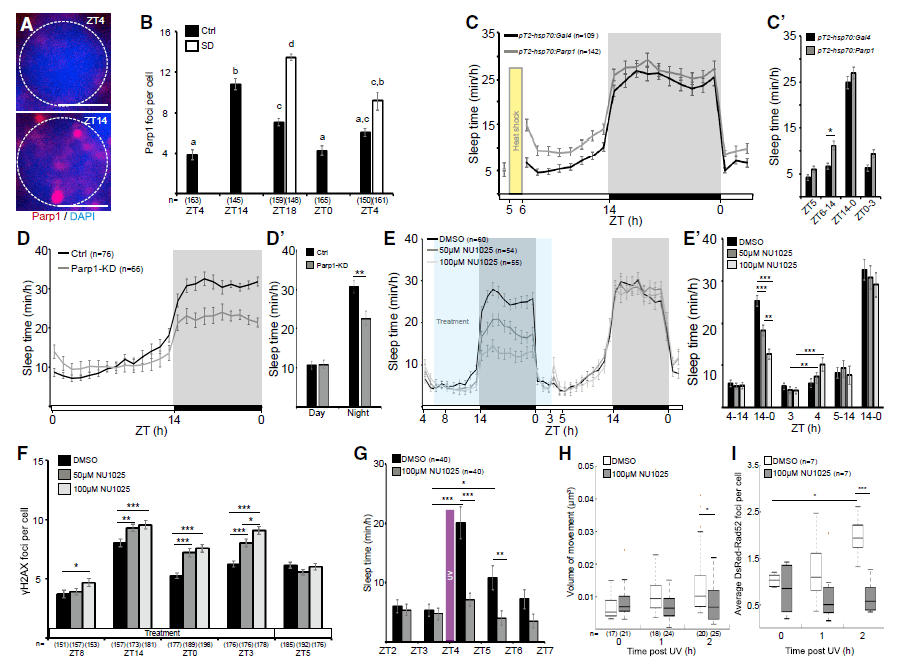
图片来源: Molecular Cell
为了进一步确认在斑马鱼上的研究结果,研究者与特拉维夫大学的 Yuval Nir 教授合作,使用脑电图在小鼠上检测了 PARP1 在调节睡眠中的作用。与斑马鱼上得到的结果相同,PARP1 活性的抑制降低了非快速眼动睡眠的持续时间和质量。Appelbaum 教授说道, 「为了进行 DNA 修复,PARP1 通路能向大脑发出信号,让我们知道需要睡觉了」。
总结
在这项研究中,揭示了 DNA 损伤是睡眠的稳态驱动因素,而 PARP1 通路可以感知这种细胞压力,提醒我们可以睡觉了,并在睡眠中进行 DNA 修复。
在醒着的时候,神经元中 DNA 损伤的积累会增加疲劳。PARP1 蛋白(黄色头盔)作为「天线」,感知并标记细胞中的 DNA 断裂,驱动睡眠,并招募修复系统(绿色和蓝色头盔)。在睡眠期间,DNA 修复系统修复休息时间,使新的一天重新开始。红色是细胞体,蓝色是核仁,绿色是 DNA 损伤位点。(Credit by Dr. David Zada)
这些最新发现在单细胞水平上详细描述了睡眠的「发生链」,这种机制还可以用于解释睡眠障碍、衰老和神经退行性疾病(如帕金森氏症和阿尔茨海默氏症)之间的联系。虽然目前研究仍停留在斑马鱼和小鼠模型阶段,但 Appelbaum 教授认为,「未来的研究将有助于将这种睡眠功能从低等无脊椎动物,最终应用到人类身上」。
感到累的时候,就好好睡上一觉吧!你睡的不是觉,是 DNA 修复。
参考文献:
https://doi.org/10.1016/j.molcel.2021.10.026
声明:该文观点仅代表作者本人,搜狐号系信息发布平台,搜狐仅提供信息存储空间服务。
吃太咸,不仅诱发高血压,还可能会导致脑缺氧...
来源:中国生物技术网 2021-12-02 13:02
近十多年来,各国的膳食指南和大量研究一再强调要避免饮食中摄入过多的盐。人们普遍关注盐摄入量的一个主要原因是它与血压的关系。最早在上世纪中期的观察性研究发现,摄入更多盐的人动脉压更高。随后的干预性试验也表明,高盐摄入量会使血压升高。但有许多人摄入了大量盐分也没有导致血压升高。因此,只有50%到60%的高血压被认为是与过量摄入盐直接相关。
那么,除了诱发高血压以外,过量摄入盐还会不会有其他影响?
近日,发表在《Cell Reports》上的一项研究中,来自美国佐治亚州立大学领导的研究团队通过新开发的神经影像学技术与外科手段相结合的方法揭示了盐摄入对大脑更深层的影响。他们观察到啮齿类动物急性盐负荷会引发大脑血管收缩,血流量减少,从而导致了局部的缺氧微环境。这一发现着实令人惊讶,因为在阿尔茨海默症和中风等疾病中也观察到了类似情况。
当神经元被激活时,它通常会使所在区域的血流迅速增加。这个过程被称为神经血管耦合(NVC,俗称功能性充血)。适当的脑功能依赖于神经血管耦合,它确保了大脑在代谢需求增加及时输送葡萄糖和氧气。
基于神经血管耦合开发的功能性磁共振成像(fMRI)等技术的应用,使研究人员在研究NVC反应的细胞机制方面有了显着进展。然而,以前的研究仍仅限于大脑背侧浅表区域(如大脑皮层),如血流如何对来自环境的感觉刺激(如视觉或听觉刺激)做出反应。对于同样的原理是否适用于与身体自身产生的刺激相协调的大脑深层区域,即所谓的内感受性信号,科学家们仍知之甚少。
在这项新研究中,研究人员使用下丘脑视上核作为模型,在解剖学和功能上与大脑皮层不同的大脑区域测量神经血管耦合。
下丘脑视上核(SON)位于大脑深层区域,具有独特的细胞结构特性,它高度血管化,并参与关键的身体功能,包括饮水、饮食、体温调节和生殖。然而,下丘脑视上核密集的血管网络却不需要维持其代谢需求。因此,研究人员认为,代谢供需的不匹配表明该系统除了提供能量底物外,还应该具有其他功能。
为此,研究人员重点研究了下丘脑的血流如何随着盐的摄入而发生改变。选择盐是因为机体需要非常精确地控制钠含量,体内甚至有特定细胞来实时检测血钠水平。当摄入盐时,大脑会感知并激活一系列使钠水平下降的代偿机制。
研究人员给大鼠静脉缓慢注射高渗盐水,并通过体内电生理学以及最新开发的体内双光子成像方法(可通过光学途径进入下丘脑腹侧)观察。
他们发现,急性盐负荷在逐渐增加下丘脑血管加压素(VP)神经元放电,引起血管收缩。减少了局部血流量。血管加压素即抗利尿激素,在维持盐的适当浓度方面发挥着关键作用。
因此,这种独特的神经血管耦合模式导致了局部的缺氧微环境。
研究通讯作者、佐治亚州立大学神经炎症和心血管代谢疾病中心主任Javier SternStern教授说:“这一发现让我们大吃一惊。因为我们观察到了血管收缩,这与大多数研究描述的大脑皮层对感觉刺激的反应相反。在阿尔茨海默症、中风或局部缺血等疾病发生后,大脑皮层的血流也会像这样减少。”
盐诱导的这一过程导致局部缺氧微环境,引起血管加压素正反馈兴奋。SternStern的团队将这种现象称为“逆向神经血管耦合(逆NVC)”,血流减少进一步将导致脑过度缺氧。
此外,他们还观察到了其他差异:在大脑皮层中,血管对刺激的反应非常局限,血管扩张会迅速发生;而在下丘脑,反应是弥漫性的,并且在很长一段时间内缓慢发生。
Stern说:“当我们摄入了大量盐的时候,体内的钠水平会在很长一段时间内保持升高。缺氧应该是一种增强神经元对持续盐刺激反应能力的机制,使它们能在很长一段时间保持活跃。”
研究人员计划在其他动物模型中研究这种反向神经血管耦合机制,以确定该机制是否驱动了盐依赖性高血压病理学。此外,他们希望用这个方法研究其他大脑区域和疾病,包括抑郁症、肥胖和神经退行性疾病。
Stern说:“如果你长期摄入大量盐,加压素神经元就会过度活化,进一步会导致过度缺氧,最终引发脑组织损伤。如果能更好地理解这一过程,我们就能设计出新的靶点来阻止这种缺氧机制的激活,并可能改善与盐相关的高血压患者的预后。”(生物谷Bioon.com)
![SiS001! Board - [第一会所 关闭注册]](images/green001/logo.png)

